The research groups of the Section of Pharmaceutical Sciences

Biomolecular & Pharmaceutical Modelling
Francesco Luigi Gervasio
Full Professor
Molecular Dynamics
Cryptic Pockets
GPCRs
Computational Biophysics
Description
Access

Biopharmacy
Gerrit Borchard
Full Professor
Nanomedicines
Biopharmaceutical Medicines
Description
Access

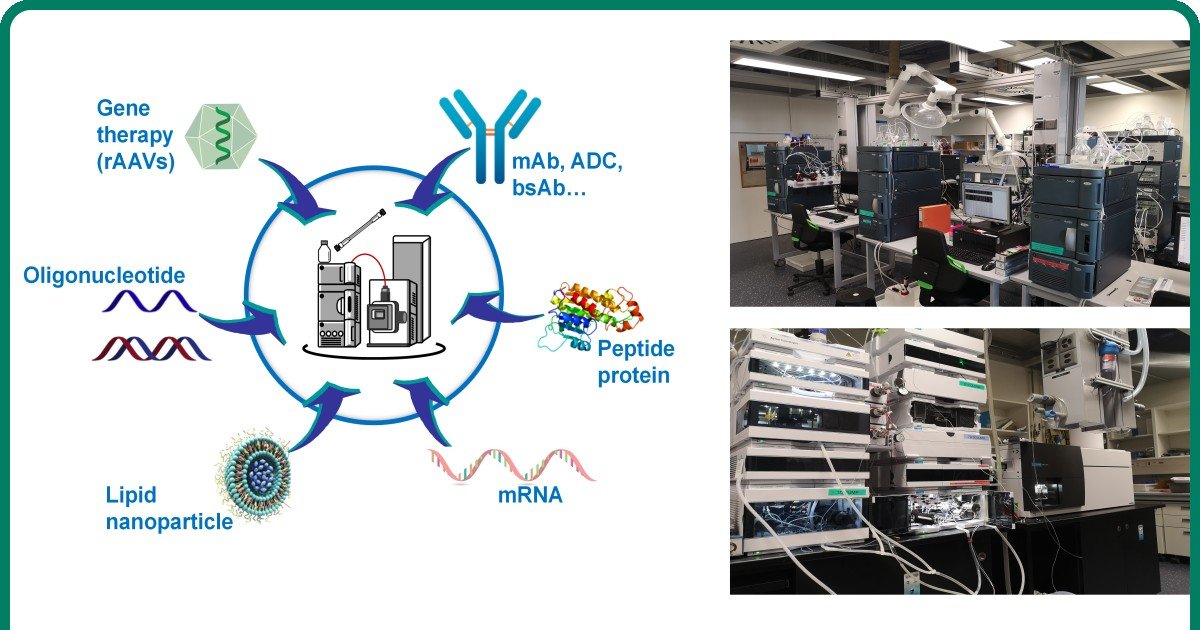
Biophysical and Bioanalytical Mass Spectrometry
Valerie Gabelica
Full Professor
Analytical sciences
Drug Discovery
Computational methods and data analysis
Description
Access

Cancer Systems Pharmacology
Patrycja Nowak-Sliwinska
Associate Professor
Drug Discovery
Computational methods and data analysis
Precision pharmacy
Systems Pharmacology Applied to Cancer
Description
Access

Clinical Pharmacology and Toxicology
Caroline Flora Samer
Associate Professor
Clinical pharmacology
Toxicology
Pharmacogenomics
Precision medicine
Description
Access

Drug dosage individualization
Drug efficacy and safety Optimisation
Tools and Guidelines for the clinic
Description
Access

Data Analytics Lab
Stephane Guerrier
Associate Professor
Biostatistics
Data Analytics in Pharmaceutical Sciences
Data Science
Statistical Modelling
Machine Learning
Efficient Design Study
Drug Formulation and Delivery Unit
Davide Brambilla
Associate Professor
Drug Delivery
Pharmaceutical Technology
Biomaterials
Nanotechnology
Microtechnology
Portable diagnostic
Description
Access

Hospital Pharmacy
Pascal Bonnabry
Associate Professor
Medication safety
Human factors & technologies
Hospital production
Continuity of care
Innovative teaching
Pharmacoeconomics
Description
Access

Medical Imaging
Norbert Lange
Associate Professor
Heme biosynthesis
Artificial antibodies
Photodynamic Therapy and Photodiagnosis
Self-assembling nanoparticles
Prodrug design
Description
Access
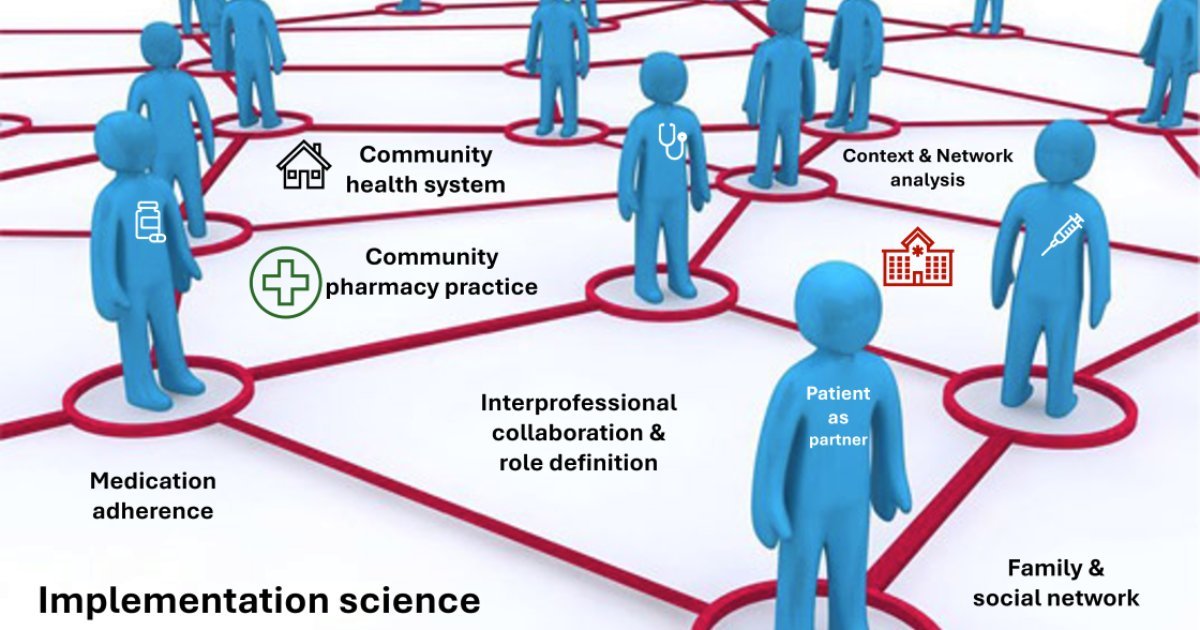
Medication Adherence and Interprofessionality
Marie Paule Schneider Voirol
Associate Professor
Medication adherence
Interprofessionality
Communication in health
Patient partnership
Description
Access

Microbiology Unit
Karl Perron
Senior Lecturer
Antibiotic resistance
Bacterial virulence
Pseudomonas aeruginosa
Antimicrobial molecules
Microbiological analyses
Description
Access
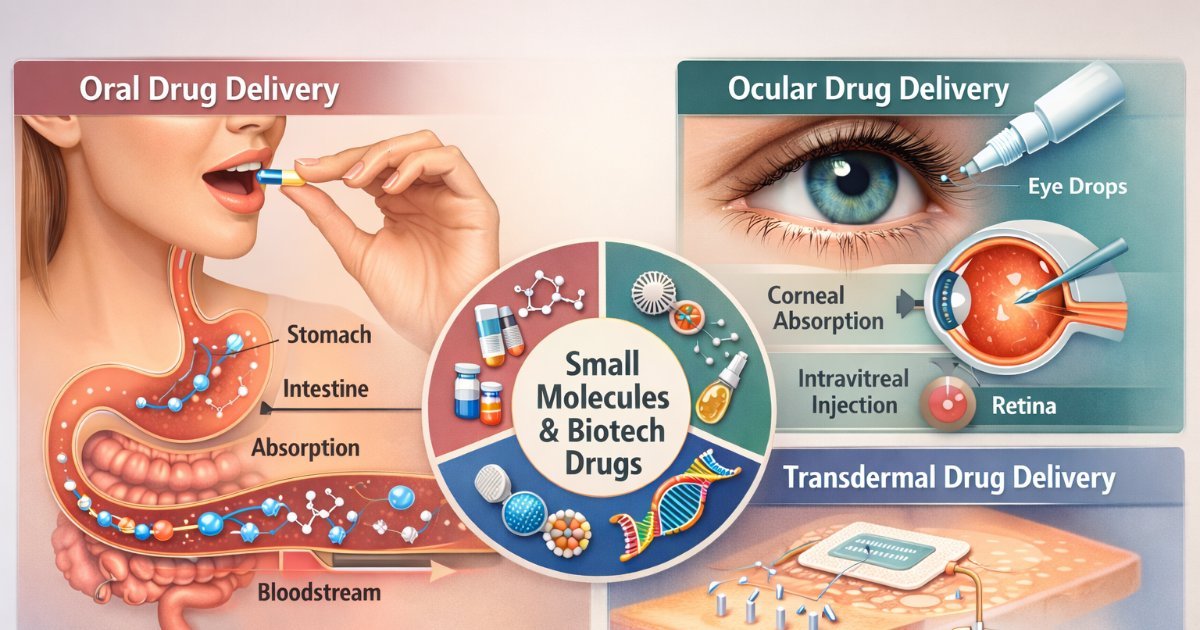
Molecular therapeutics delivery group
Yogeshvar Kalia
Full Professor
Drug Discovery
Drug Formulation
Ex vivo models
Description
Access

Pharmaceutical Biochemistry
Leonardo Scapozza
Full Professor
Drug Discovery
Computational methods and data analysis
Precision pharmacy
Description
Access
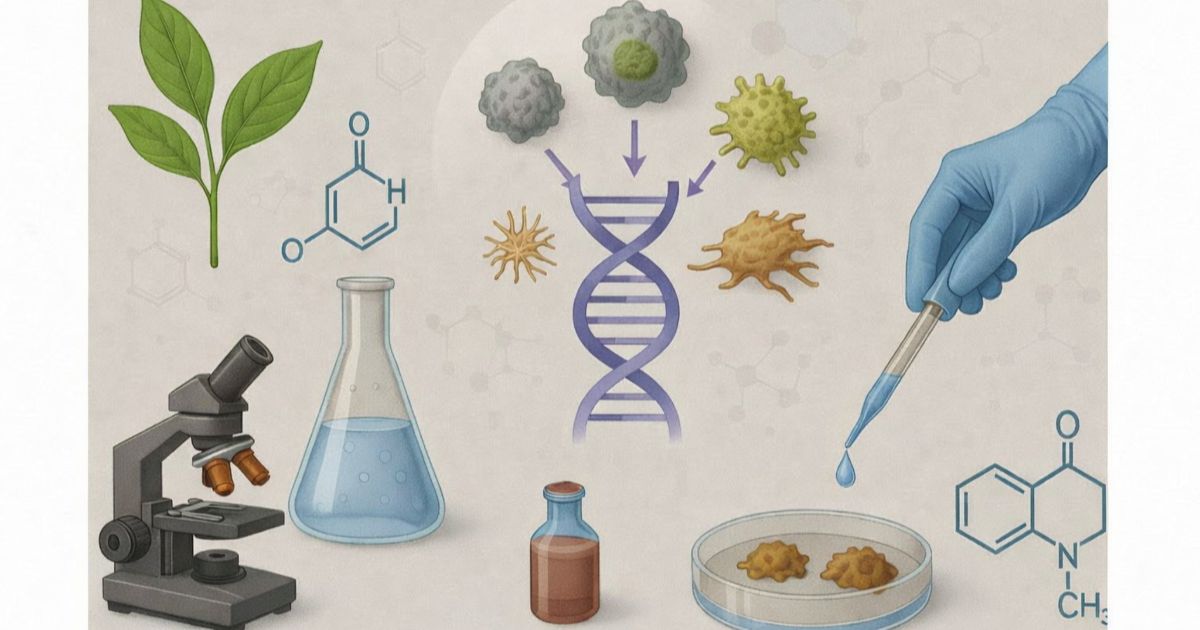
Pharmacognosy
Muriel Cuendet
Full Professor
Drug Discovery
3D cell models
Microenvironment
Description
Access

Specialised Centre for Emergency and Disaster Pharmacy
Pascal Bonnabry
Associate Professor
Global Pharmacy
Description
Access